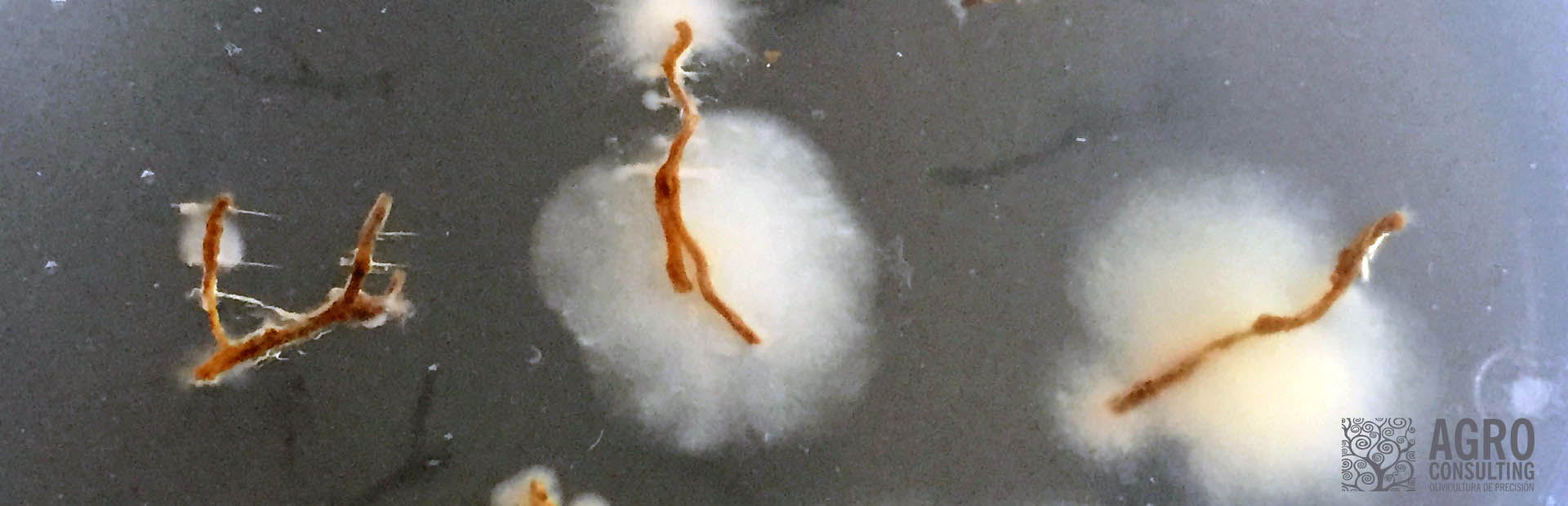
El verano representa un ambiente hostil para la mayoría de los fitopatógenos cuyo crecimiento se ve limitado, y por tanto no es la mejor época para realizar análisis fitopatológicos para su identificación.
RAZONES POR LAS QUE LOS FITOPATÓGENOS SE RALENTIZAN
En verano los fitopatógenos ralentizan su crecimiento por factores ambientales adversos, especialmente por altas temperaturas, escasez de agua/falta de humedad y alta radiación UV. Estos factores superan sus límites fisiológicos y reducen las oportunidades de infección. Esta pausa no los elimina; simplemente entran en latencia mediante estructuras de supervivencia, listos para reactivarse cuando el otoño devuelva temperaturas moderadas y humedad abundante.
| Factor abiótico | Efecto directo sobre el patógeno | Consecuencia epidemiológica |
| Temperaturas elevadas (> 30–32°C) La mayoría de los fitopatógenos tienen un rango óptimo de crecimiento entre 15°C y 25°C. | – Desnaturalización de enzimas y alteración de membranas. – Pérdida de turgencia del micelio y de las células bacterianas. – Activación de mecanismos de “heat‑shock” que detienen la división celular. | – Cuando las temperaturas superan los 30°C o incluso los 40°C, se inhibe su metabolismo o incluso puede dañar sus estructuras celulares. – Menor tasa de multiplicación y colonización; paso a estados de resistencia (esclerocios, clamidosporas, quistes, etc.) – Algunas especies pueden entrar en estado latente o detener su desarrollo para protegerse del estrés térmico. |
| Déficit hídrico en suelo Los hongos necesitan altos niveles de humedad ambiental y de suelo para desarrollarse, ya que su estructura (hifas y esporas) es muy dependiente del agua. | – Reducción del potencial hídrico necesario para germinar esporas y formar tubos germinativos. – Imposibilidad de movilidad (zoosporas, bacterias) sin película de agua. – Desecación del micelio. – Reducción en la esporulación. – Mayor vulnerabilidad frente a la radiación UV | Disminuye la infección primaria y la reinfección secundaria; prevalece la latencia |
| Radiación UV intensa | – Daño directo en ADN y ARN de las esporas y el micelio. – Oxidación de lípidos en membranas. | – Pérdida de viabilidad de inóculo aéreo; menor esporulación superficial – Reducción de viabilidad y capacidad de infectiva del hongo. |
| Viento seco | El viento cálido y seco incrementa la evaporación foliar secando rápidamente las hojas y reduciendo la humedad superficial necesaria para la germinación. | Inhibe el microclima necesario para la germinación y desarrollo del hongo. |
| Estrés fisiológico del hospedante | – El olivo cierra estomas, engrosa cutícula y lignifica tejidos. – Menos brotes tiernos y menos aporte de savia | Se reducen los puntos de entrada y la disponibilidad de nutrientes, dificultando la colonización |
| Competencia y antagonismo microbiano | – Algunos microorganismos saprófitos y termotolerantes utilizan los exudados acumulados, compitiendo por recursos. – Mayor producción de antibióticos naturales en suelos secos | Desventaja competitiva para patógenos sensibles al calor y a la desecación. Este comportamiento es especialmente común en hongos saprófitos y micorrícicos. |
¿CÓMO ACTÚAN LOS PRINCIPALES FITOPATÓGENOS DEL OLIVAR?
Hongos fitopatógenos (ej. Verticillium dahliae, Colletotrichum spp.)
- Forman estructuras de resistencia (esclerocios y clamidosporas) cuando el potencial hídrico baja y la temperatura supera su óptimo desarrollo.
- La germinación de esporas foliares requiere humedad relativa > 85 %; por debajo, la pared de la espora se endurece y pospone el crecimiento.
- Algunos hongos fitopatógenos han desarrollado mecanismos de defensa contra la radiación UV, de manera que, segregan pigmentos protectores como la melanina que absorben los UV y funcionan como barrera contra el daño celular confiriéndoles cierta resistencia. Este es el caso de Alternaria alternata. Esto no significa que este hongo se mantenga activo en verano, sino que, sus estructuras de resistencia son más eficaces.
- Los hongos de suelo, como Fusarium spp, en condiciones adversas forma clamidosporas que le permiten sobrevivir en el suelo por largos períodos. Su actividad disminuye o se paraliza por estrés térmico, aunque el hongo no muere. A pesar de ser verano, si hay riego por goteo o precipitaciones localizadas se puede crear un microclima en el suelo que mantenga una humedad suficiente para su desarrollo. La humedad en la zona radicular es clave, si se acumula agua por mal drenaje, el hongo se activa fácilmente.
Bacterias fitopatógenas (ej. Pseudomonas savastanoi)
- Necesitan película de agua para penetrar por estomas o heridas.
- Con RH < 70 % y temperaturas > 35 °C la pared celular pierde integridad y se induce un estadio de resistencia, en el cual, la bacteria es viable para su supervivencia, pero no es capaz de desarrollar su ciclo vital.
Oomicetos (Phytophthora spp y Pythium spp)
- Sus zoosporas flageladas no pueden desplazarse sin agua libre.
- El calor acelera la pérdida de flagelos y obliga a enquistarse (quistes, estructuras de resistencia).
Nematodos (ej. Meloidogyne spp.)
- La tensión superficial del suelo seco impide el movimiento activo.
- Los huevos permanecen en diapausa hasta que la humedad sube y la temperatura desciende.
IDENTIFICACIÓN Y DIAGNÓTICO DE ENFERMEDADES
En este periodo de latencia realizar análisis fitopatológicos para su identificación no es recomendable. En laboratorio, aun trabajando en condiciones controladas de temperatura y humedad, los hongos paralizan su actividad y no se desarrollan con normalidad, lo que se traduce en resultados poco precisos, o incluso falsos negativos, que desvirtúan el diagnóstico de la enfermedad. Este es el motivo por el que durante los meses de verano (Junio-Septiembre), o cuando la temperatura y la humedad no son óptimas, no realizamos análisis fitopatológicos. Como ejemplo, Verticillium dahliae es un hongo de crecimiento lento, para su identificación en circunstancias normales suele tardar entre 40 y 45 días en desarrollarse en placa. Mientras que en condiciones desfavorables principalmente con altas temperaturas se duplica el periodo de crecimiento o directamente no crece.
REFERENCIAS
- Agrios, G.N. (2005). Plant Pathology (5ª ed.)
- López-Escudero, F.J., & Mercado-Blanco, J. (2011). Verticillium wilt of olive: a case study to implement an integrated strategy to control a soil-borne pathogen. Plant and Soil, 344(1), 1–50.
- Trapero, A., et al. (2005). El repilo del olivo: biología del patógeno y medidas de control. Junta de Andalucía.
- Crous, P.W. et al. (2013). Colletotrichum species – current status and future directions. Studies in Mycology, 76(1), 1–29.
- EPPO Global Database
- FAO – Manuales de fitosanidad y protección vegetal
- Caballero, J.M., et al. (2008). El cultivo del olivo (Barranco, D. et al., eds). Mundi-Prensa.
- Jiménez-Díaz, R. M., et al. (1991). “Ecology and epidemiology of fusarium wilt in Mediterranean crops.”
- FAO & CIHEAM. (2020). Health Management in Olive Orchards. Integrated Pest and Disease Control.
- Sánchez-Hernández, E., et al. (2016). “First report of Fusarium solani causing root rot in olive trees in Spain.” Plant Disease.
- Domínguez, J., et al. (2021). “Relación entre condiciones de estrés hídrico y enfermedades radiculares en el olivo.” Jornada Técnica IFAPA.
- CABI Invasive Species Compendium – Fusarium oxysporum
- Markakis, E.A., et al. (2018). Seasonal variation in the incidence and severity of olive leaf spot (Venturia oleaginea) in relation to environmental conditions. Phytopathologia Mediterranea.
- Fernández-Escobar, R., et al. (2013). Seasonal nutrient dynamics in olive trees and its relation to disease expression. Acta Horticulturae.